-
点击蓝字 关注我们 前 言 当下,医疗领域最受瞩目的关键词,无疑是“细胞疗法”。从癌症免疫治疗,到再生医学修复,它被视为人类与顽疾较量的新武器。但长期以来,公众对它的印象更多停留在“昂贵”“小众”“试验阶段”。然而,9月12日的一纸《生物医学新技术临床研究和临床转化应用管理条例(草案)》的出台,让这一格局迎来重大转折。国务院常务会议明确提出,要加快生物医学新技术的研发与成果转化,同时依法规范临床研究,保障安全与质量。这意味着,曾经遥不可及的前沿疗法,正在从实验室走向大众。问题来了:这个新条例,到底会如何改变我们普通人的医疗未来?细胞疗法,真的有望实现“全民普及”吗?01免细胞疗法的时代背景——“从试验室走向临床”细胞疗法,顾名思义,是通过改造或利用人体细胞来治疗疾病。它并非科幻,而是实实在在的临床研究成果。比如,近年来风靡全球的CAR-T疗法,已经被美国FDA批准用于多种血液癌症,部分患者的五年生存率提升至42%。中国在这一领域同样动作频频——截至2023年,中国已启动超过500项CAR-T相关临床试验,...
-
点击蓝字 关注我们 2025 年 7 月 31 日,湖南省第十四届人民代表大会常务委员会第十七次会议表决通过《湖南省细胞和基因产业促进条例》(以下简称《条例》),该条例自 2025 年 10 月 1 日起正式施行。作为湖南省规范和推动细胞与基因产业发展的重要地方性法规,《条例》的出台旨在促进产业高质量发展、有效防范生物安全风险、切实满足人民群众健康需求,标志着湖南省在生物医药领域法治化建设进程中迈出关键一步。《条例》明确规定,对于正在开展临床试验、用于治疗严重危及生命且尚无有效治疗手段疾病的细胞和基因产品,在经医学观察可能使患者获益且符合伦理原则的前提下,经审查并获得患者知情同意后,可在开展临床试验的医疗机构内,通过拓展性使用或拓展性临床试验,应用于其他未参加临床试验且病情相同的患者。同时,《条例》提出,对取得阶段性成果的细胞和基因产品,可优先开展拓展性使用或拓展性临床试验。 上述规定既为创新疗法在临床急需场景中的合理应用提供了制度保障,也通过严格的审查程序与伦理要求筑牢风险防线,在鼓励产业创新与保障患者权益之间实...
-
点击蓝字 关注我们 湖南省人大于近日通过了《湖南省细胞和基因产业促进条例》,在之前公布的深圳促进条例基础上又有新突破。 最大的突破就是明确了危重患者用药通道,允许对严重危及生命且无有效治疗手段的疾病,在符合伦理前提下,将临床试验中的细胞产品通过拓展性使用或临床试验用于未参与试验的患者。 这基本上等于说危重病人,打比方说ALS、肾衰、肝衰、心衰、脑卒中等等病人就有了干细胞应用通路,而一些肿瘤病人有了免疫细胞应用的的通路。 特别针对下面最后一条,对于企业而言只要有阶段性成果的细胞产品,那么就可以去和医疗机构合作,谈拓展性使用,当然也就可以收费。 还有一条利好就是,如果属于医疗新技术项目,那么在获批后就可以由医疗机构去申报新增医疗服务价格。 针对企业而言,采集也很重要,条例明确了企业可以委托医疗机构进行采集。 其他还有一些支持政策,对于企业和医疗机构也是比较友好的。譬如不纳入床位周转率计算、伦理结果互认等等。 关键地,针对湘江新区、自贸区还可以制定和实施本区域促进的相关措施!这个就更有想象空间了。 本篇...
-
点击蓝字 关注我们 前 言 2025年7月31日,一纸《湖南省细胞和基因产业促进条例》的公布,打破了沉寂多年的人类医疗新赛道。这是全国首部专门聚焦细胞与基因产业的地方法规,自10月1日起生效,不仅填补了中国在该领域立法的空白(省级),也传递出一个强烈信号:再生医学时代,地方政府已不再观望,开始主动“立规破局”。 这是一次真正意义上的政策超前布局。长期以来,细胞治疗、基因编辑、CAR-T等前沿技术在中国处于“技术已来,规则未至”的真空状态——审批机制不清晰、伦理边界不统一、市场路径模糊,导致产业发展举步维艰。而湖南此次直接以立法方式明确产业定位、技术规制、伦理红线和行政责任,无疑是一次地方立法向科技变革的深度嵌入。 这部条例并非空泛口号,它覆盖了从研发、采集、储存、生产、应用到拓展性使用、临床试验、医保转化、数据安全、伦理治理的全过程闭环,甚至对监管、融资、保险、知识产权等环节都设立了系统化支持条款。为什么是湖南敢第一个吃螃蟹?它到底解决了哪些关键难题?条例背后,又预示着怎样的新变局? 01首创制度突破,...
-
点击蓝字 关注我们 为进一步完善药品附条件批准上市申请审评审批制度,国家药品监督管理局组织起草了《药品附条件批准上市申请审评审批工作程序(试行)(修订稿征求意见稿)》及有关政策解读。在前期工作基础上,现再次向社会公开征求意见。 请于2025年8月7日前,将有关意见按照《意见反馈表》格式要求反馈至电子邮箱hxypc@nmpa.gov.cn,邮件标题请注明“药品附条件批准上市申请审评审批工作程序意见反馈”。 附件:1.药品附条件批准上市申请审评审批工作程序(试行)(修订稿征求意见稿) 2.《药品附条件批准上市申请审评审批工作程序(试行)》政策解读(征求意见稿) 3.意见反馈表 本篇文章来源于微信公众号:中启源生物科技...
-
点击蓝字 关注我们 前 言 Cancer Cell重磅研究:化疗竟激活休眠癌细胞,揭开癌症复发的隐藏通道 我们总以为,化疗是一场“杀敌到底”的战斗,是摧毁癌细胞的最后一道屏障。然而,最新一项发表于《Cancer Cell》的研究却令人震惊:某些化疗药物并没有彻底清除癌细胞,反而可能“吵醒”了那些本来沉睡、无害的休眠癌细胞。这就像你以为敌人已经倒下,却不知一次“误炸”唤醒了地下的潜伏部队。这项发现重新定义了癌症治疗中的“复发”概念——原来,化疗不止可能“治不干净”,还可能“激活沉睡的威胁”。那么,究竟是谁在背后操控这一切?答案指向了一个曾被忽视的“细胞网军”——中性粒细胞胞外诱捕网(Neutrophil Extracellular Traps, NETs)。01复发之谜:为什么癌细胞总在我们以为“结束”的时候卷土重来?癌症治疗的一个巨大谜团是:明明肿瘤已经手术切除、化疗完成,甚至标志物清零,为何几年后还会突然复发,甚至扩散得更快?这背后隐藏着一种鲜为人知的生物状态——休眠癌细胞(dormant cancer cells)。它们像“冬眠动物”一样,暂时停止生长...
-
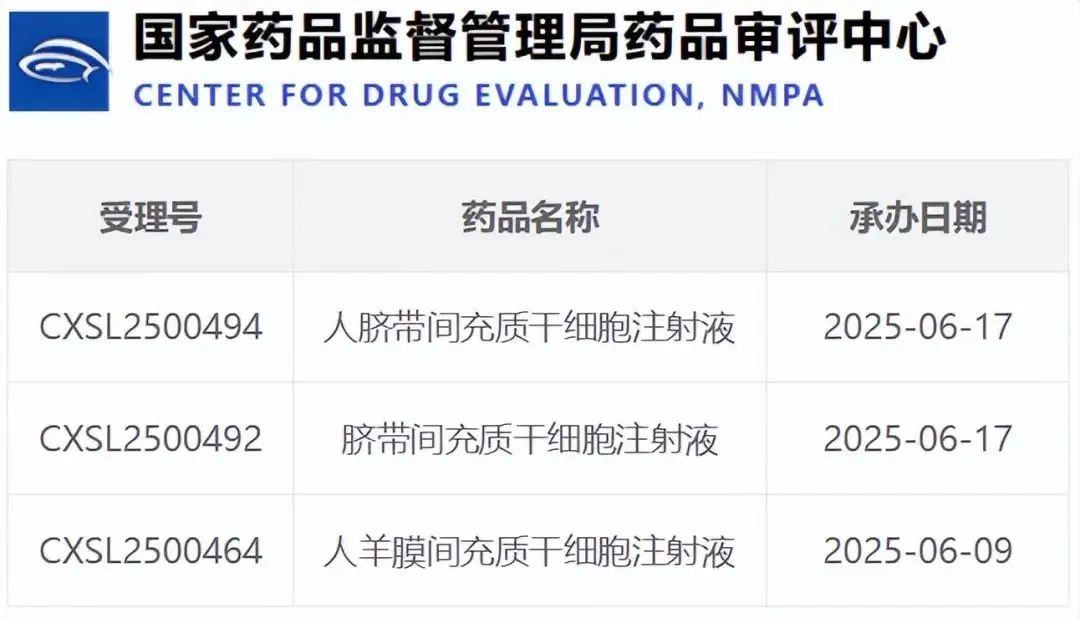
点击蓝字 关注我们 前 言 2025年6月,中国细胞治疗发展迎来一个重要信号:国家药品监督管理局药品审评中心(CDE)共受理9项细胞治疗新药临床试验申请,涵盖间充质干细胞(MSC)、CAR-T、CAR-NK、树突状细胞(DC)等多条核心技术路径。 这不是一次简单的数据堆积,而是中国细胞治疗由“散点式突破”转向“系统化布局”的标志性节点。监管提速、路径清晰、适应症扩展,预示着细胞治疗产业正进入一个多线并行、加速兑现的全新阶段。从修复组织、调节免疫到清除肿瘤,这些细胞药物正在拓宽医学的边界,也为众多难治性疾病带来前所未有的治疗可能。 01干细胞产品稳步推进,瞄准疑难病与慢性炎症 本月获批的三款间充质干细胞(MSC)治疗产品,分别用于类风湿性关节炎、脑损伤和肝硬化等重大疾病,显示出干细胞在“组织再生+免疫调节”双重机制下的广泛应用潜力。 类风湿等自身免疫疾病,往往缺乏根治方案,而干细胞通过分泌抗炎因子、抑制免疫攻击、修复受损组织,有望从机制层面“打断”病程循环。脑损伤与肝纤维化等病变,亦存在传统治疗效果有限...
-
点击蓝字 关注我们 前 言 2025年6月30日,国家医保局与国家卫健委联合发布《支持创新药高质量发展的若干措施》,文件用16条具体政策直面“研发难、准入难、推广难”三大系统性瓶颈。这不仅是一份制度层面的“施工图”,更是打开下一代治疗技术通路的“通关密钥”。 从支付模式到准入机制,从价格谈判到临床转化,一整套针对创新药的新型医保支付路径被系统性确立。细胞治疗作为近年来最受关注的“革命性技术”之一,在这轮政策东风中正迎来实打实的机会窗口。 01全生命周期式设计,打破研发“闭环困境”创新药的路径,从来不是一个单点爆破的问题,而是一条“研发—申报—注册—临床—推广”的长链条。过去,在这条链条上的任何一个环节遇阻,都可能导致成果“卡壳”、技术“夭折”。 此次《若干措施》首次将政策触角延伸至整个生命周期,全链条发力,体现了制度设计者对创新药生态的深刻理解。例如,文件明确支持高风险高价值的原创成果早期孵化,鼓励高校、科研院所和初创企业以成果转化为导向,与产业形成闭环。同时,通过构建多元试验平台、强化数据互通机制,...