已获批上市间充质干细胞药物盘点:适应症、价格、销量

2025年1月2日,中国国家药监局(NMPA)正式批准了艾米迈托赛注射液的上市,这标志着我国首款间充质干细胞(MSC)治疗药物的问世。该药物主要用于治疗14岁以上的激素治疗失败的急性移植物抗宿主病(aGVHD),为这一领域的患者提供了新的治疗选择。
艾米迈托赛注射液是由铂生卓越生物科技(北京)有限公司研发的人脐带间充质干细胞注射剂。自2013年首次提交新药临床研究申请以来,该产品经历了多年的研发和临床试验。其在II期临床试验中显示出一定的治疗效果,尤其是在接受多次输注的患者中,表现出较好的疗效。
韩国产品
间充质干细胞药物①
——
CellGram:急性心肌梗死
批准国家:韩国 批准日期:2011年7月1日 细胞类型:自体骨髓间充质干细胞 适应症:急性心肌梗死(AMI) 价格:1800万韩元(约合15,000美元),且不在医保报销范围内。 销量:2018年,达到25亿韩元的峰值,随后开始下降,2023年为8亿韩元。 概况:CellGram作为全球首个获批的干细胞药物,标志着干细胞治疗取得重大突破。临床试验显示,治疗后6个月,患者左心室射血分数提升约6%。上市初期,CellGram需提交600名患者临床数据,尽管Pharmicell尝试将这一要求减至60人但未获批准,引发业界对其后续审批的关注。 2022年,CellGram被重新定位为先进生物制药产品,显示出其在现行监管框架下的持续发展潜力。

间充质干细胞药物②
——
Cartistem:退行性关节炎
批准国家:韩国 批准日期:2012年1月 细胞类型:脐带血间充质干细胞 适应症:退行性关节炎和膝关节软骨损伤 价格:1.9-2.1万美元 销量:累计给药患者人数突破3.1万,累计销售额达到1080亿韩元,2023年超过200亿韩元(约1440万美元)。 概况:Cartistem作为世界首个同种异体脐带血干细胞疗法,已证实能有效抑制炎症并促进受损软骨组织再生。Medipost正筹备在日本与美国的Cartistem 3期临床试验,并有意进军马来西亚等东盟市场。 在日本,符合条件的产品可跳过1、2期,直接进入3期试验阶段。

间充质干细胞药物③
——
Cupistem:克罗恩病
批准国家:韩国 批准日期:2012年1月 细胞类型:自体脂肪间充质干细胞 适应症:克罗恩病的复杂性肛瘘 价格:约600万韩元(约5000美元/次) 销量:未公开 概况:Cupistem的一大亮点在于其疗效持久,81%接受治疗的患者在96周后仍维持愈合状态。2014年,该疗法获得韩国健康保险审查与评估服务(HIRA)的医保定价批准,显著提升了患者的经济可及性。

间充质干细胞药物④
——
NeuroNATA-R:肌萎缩侧索硬化症
批准国家:韩国 批准日期:2014年7月30日 细胞类型:自体骨髓间充质干细胞 适应症:肌萎缩侧索硬化症(ALS)和其他运动神经元病 价格:1.8万至7.2万美元 销量:未公开 -
概况:NeuroNATA-R通过自体骨髓间充质干细胞注射,发挥神经保护作用,延缓运动神经元凋亡,有效减缓ALS病情进展。一项I期临床试验评估其安全性,7例患者接受鞘内注射并随访12个月,结果显示该治疗方案安全性能良好。

Mesoblast公司产品
间充质干细胞药物⑤
——
Prochymal:移植物抗宿主病
批准国家:加拿大 批准日期:2012年5月17日 细胞类型:骨髓间充质干细胞 适应症:儿童急性移植物抗宿主病(GvHD) 价格:20万美元/疗程(通常4剂) 销量:不详 概况:Prochymal作为一款即用型干细胞产品,便捷地通过静脉注射给予,省去了配型与免疫抑制的复杂步骤。它在美国可通过扩展访问计划获取,同时在新西兰、瑞士等多个国家也已获得官方批准。 Prochymal于2009年首次在美国获得批准,随后被Osiris公司出售给澳大利亚的Mesoblast公司,并更名为Ryoncil。
间充质干细胞药物⑥
——
Temcell:移植物抗宿主病
批准国家:日本 批准日期:2015年9月 细胞类型:骨髓间充质干细胞 适应症:急性移植物抗宿主病(GvHD) 价格:868,680日元(约合7,700美元)/袋,一个标准疗程通常需要8袋,因此总费用约合12.3万美元)到18.5万美元。 销量:2024年10月30日财报显示,当季销售15亿日元(约950万美元) 概况:Temcell,由Mesoblast公司研发并由日本JCR制药市场推广,临床试验中展现出色疗效,尤在治疗类固醇难治性急性移植物抗宿主病上表现突出。数据显示,接受Temcell治疗的患者,28天后总体反应率高达56%。 此外,Temcell被纳入日本国民健康保险,为患者提供费用报销,减轻了经济负担。

间充质干细胞药物⑦
——
Ryoncil:移植物抗宿主病
批准国家:美国 批准日期:2024年12月18日 细胞类型:骨髓间充质干细胞 适应症:用于治疗2个月及以上儿童的类固醇难治性急性移植物抗宿主病(SR-aGVHD)。 价格:尚未公开 概况:Ryoncil成为FDA首个批准的间充质干细胞(MSC)疗法。一项多中心、单臂III期临床试验结果显示,70%患者治疗后28天展现总体反应,与生存率紧密相关。 作为创新的MSC治疗产品,Ryoncil为类固醇难治性急性移植物抗宿主病患者带来新希望,未来或将应用于更多适应症。
印度产品
间充质干细胞药物⑧
——
Stempeucel:严重肢体缺血
批准国家:印度、欧盟 批准日期:2015年6月(在欧盟获得孤儿药地位) 细胞类型:骨髓间充质干细胞 适应症:严重肢体缺血 价格:2200美元(2017年) 销量:未公开 概况:Stempeucel历经12年研发,采用创新的池化技术,优化了生产流程,确保能为众多患者提供治疗。临床试验证实,Stempeucel在增进严重肢体缺血患者的血流及功能改善方面成效显著。

日本产品
间充质干细胞药物⑨
——
Alofisel:克罗恩病
批准国家:欧盟、日本 批准日期:2018年3月23日(在欧盟获得批准),随后在日本也获得了批准。 细胞类型:脂肪间充质干细胞 适应症:复杂性肛瘘 价格:562万日元/剂(约3.6万美元) 销量:2020财政年度,Takeda从Alofisel获得的收入约35万美元。 概况:Alofisel在临床试验中安全性表现良好,但最新研究显示其疗效与安慰剂无显著差异,引发对其临床效益的质疑。2024年12月,欧盟因缺乏确凿疗效数据而决定撤销Alofisel的市场授权。
间充质干细胞药物⑩
——
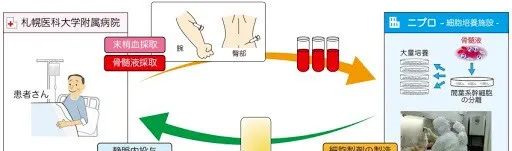
Stemirac:脊髓损伤
批准国家:日本 批准日期:2018年11月21日(获得条件性和时间限制的批准) 细胞类型:骨髓间充质干细胞 适应症:脊髓损伤相关的神经功能障碍 价格:约1500万日元/剂(9.5万美元) 销量:据2019年的一篇文章预测,Stemirac将在未来9年中,每年给Nipro公司带来约340万美元的收入。 概况:Stemirac在日本获有条件及时限批准上市,同时Nipro公司需在七年内提交更多临床数据以验证其有效性。该疗法在临床试验中安全性佳,被日本政府视为突破性产品,旨在加快上市步伐,为急需治疗的患者提供新选项。
间充质干细胞药物⑪
——
AKUUGO:创伤性脑损伤
批准国家:日本 批准日期:2024年7月31日(获得条件性和时间限制的批准) 细胞类型:骨髓间充质干细胞 适应症:改善创伤性脑损伤(TBI)引起的慢性运动瘫痪 价格:尚未公开 销量:尚未公开 概况:AKUUGO是一种同种异体间充质干细胞产品,通过向培养细胞暂时转染人Notch-1胞内结构域基因,显著提升了其促进神经细胞再生的能力。研究显示,AKUUGO不仅具备神经保护效应,还能促进血管新生并发挥重要的免疫调节作用。
伊朗产品
间充质干细胞药物⑫
——
Mesestrocell:骨关节炎
批准国家:伊朗 批准日期:2018年 细胞类型:骨髓间充质干细胞 适应症:骨关节炎 价格:2亿伊朗里亚尔(约4600美元)
间充质干细胞药物⑬
——
StemSin
批准国家:伊朗 批准日期:2018年 细胞类型:骨髓间充质干细胞 适应症:多发性硬化症 价格:未公开
间充质干细胞药物⑭
——
AlloStemSin
批准国家:伊朗 批准日期:2018年 细胞类型:脐带间充质干细胞 适应症:肌萎缩侧索硬化症 价格:未公开
间充质干细胞药物⑮
——
Vartocell
批准国家:伊朗 批准日期:2020年 细胞类型:脐带间充质干细胞 适应症:脑瘫 价格:1亿伊朗里亚尔(每瓶含2000万个细胞)约2300美元
中国产品
间充质干细胞药物⑯
——
艾米迈托赛注射液:移植物抗宿主病
批准国家:中国 批准日期:2025年1月2日 细胞类型:脐带间充质干细胞 适应症:用于14岁以上患者的激素治疗失败的急性移植物抗宿主病(aGVHD),尤其是消化道受累为主的病例。 价格:尚未公开 概况: 这是中国首款获批的干细胞治疗药物,标志着国内干细胞药物研发迈入重要阶段。艾米迈托赛注射液利用人脐带间充质干细胞,有效修复受损组织并调节免疫功能,临床试验中展现出卓越疗效与安全性。
该药物经中国国家药监局优先审评审批程序上市,凸显其临床迫切需求与显著优势。作为处方药在医院使用,为患者带来全新治疗途径。
来源:免疫和再生医学

本篇文章来源于微信公众号:中启源生物科技







