最新!国家药监局批准我国首款干细胞治疗药品(艾米迈托赛注射液)上市!

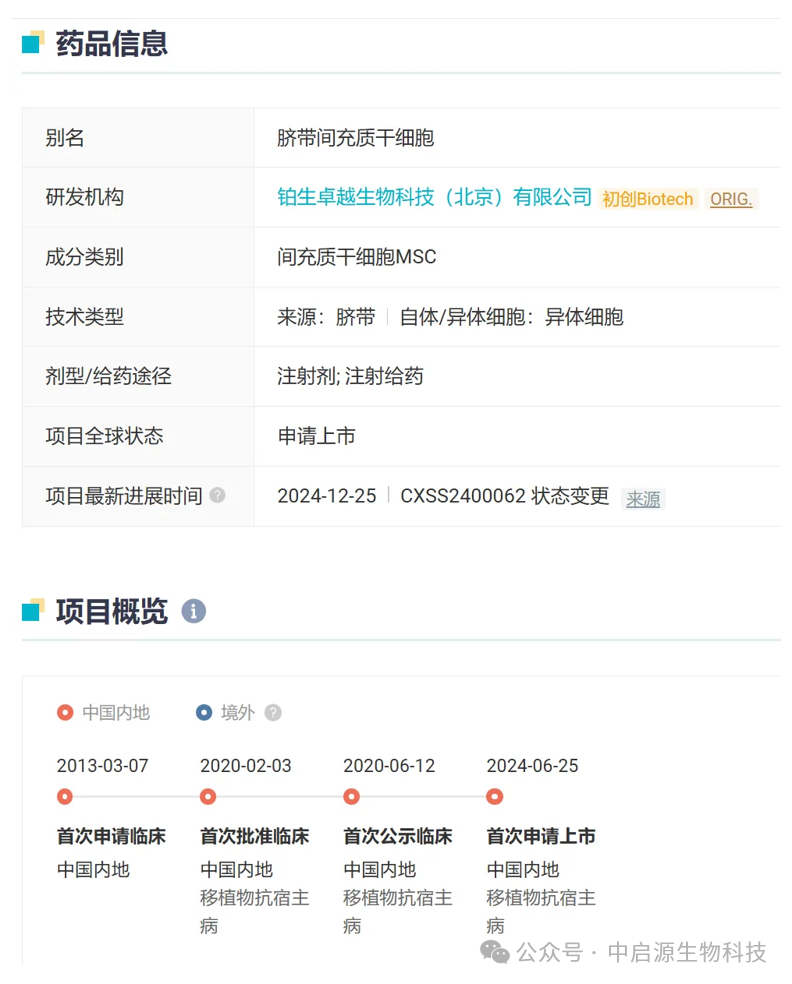
2025年1月2日,国家药品监督管理局(NMPA)官网宣布,铂生卓越生物科技(北京)有限公司开发的干细胞疗法“艾米迈托赛”正式获批上市,用于治疗14岁以上患者因消化道受累而对激素治疗无效的急性移植物抗宿主病。这标志着国内首款干细胞疗法的上市。

截图来源:NMPA 官网
艾米迈托赛是一种间充质干细胞疗法(MSC)。该药物自2013年3月在国内提交了新药临床试验申请(IND),但直到2020年6月才首次公开临床试验信息。2024年6月12日,艾米迈托赛被国家药监局药品审评中心(CDE)纳入优先审评审批程序,并于同月25日正式提交了新药上市申请(NDA),进入受理阶段。如今,该药物获批上市,标志着国内在干细胞治疗领域迈出了重要的一步,成为同类疗法的一个重要里程碑。
艾米迈托赛已经完成了II期临床试验,目前正在进行III期临床试验。虽然在II期探索性临床试验中,间充质干细胞(MSC)组在第28天时的客观缓解率(ORR)并未显著高于安慰剂组,但在平均两周后,MSCs逐渐显示出治疗效果。完成8次输注的患者,尤其是肠道受累的患者,可能会从中获益.

国家药监局药品审评中心副主任王涛表示,自2017年以来,我国已批准120多款干细胞药品进入临床试验阶段,适应症涵盖血液系统、呼吸系统、心血管系统以及自身免疫系统疾病等.
细胞治疗产品是全球医药发展的前沿和热点领域。国家药监局持续深化药品审评审批制度改革,设立加快临床急需新药上市的通道,加强政策引导,完善评价体系和标准,增强技术指导和沟通交流服务,助力创新疗法早日惠及患者。
2024年,国家药监局批准上市的创新药达48个,包括罕见病用药等重点领域的多款新药,加速上市进程。部分创新药实现了全球同步研发、同步申报、同步审评和上市,甚至部分药物在全球率先上市,更好地满足了我国公众的用药需求.

本篇文章来源于微信公众号:中启源生物科技







