细胞科普丨Cell实锤:NK细胞不是“独行侠”,而是抗癌免疫系统的“指挥官”
点击蓝字 关注我们

引言
最新研究彻底颠覆了我们对NK细胞的传统认知。
长久以来,NK细胞被视为免疫系统中的"独行侠",能够不依赖其他免疫细胞独立识别和杀伤肿瘤细胞。然而,《Cell》杂志最新发表的一项由英国Francis Crick Institute和瑞士洛桑大学共同完成的研究揭示,NK细胞实际上是肿瘤免疫应答的关键组织者和协调者。
研究发现,NK细胞通过分泌特定的趋化因子,能够精准招募树突细胞(cDC1)进入肿瘤微环境,进而激活T细胞,形成一条完整的"NK-树突细胞-T细胞"免疫攻击链。

也就是说,真正有效的肿瘤免疫,不是靠CD8+ T细胞“单刀直入”,而是靠NK细胞“打开局面、派兵布阵”。
这项研究将NK细胞从“执行者”提升为“指挥官”,重新定义了它在肿瘤免疫生态中的核心角色。
01
NK细胞如何“指挥战局”?
关键在两个“信号弹”
国际研究团队在多项肿瘤模型研究(涵盖黑色素瘤、乳腺癌及头颈癌)中取得重大发现:肿瘤微环境中cDC1树突状细胞的浸润程度直接决定了T细胞的活化效能及其对癌细胞的清除能力。
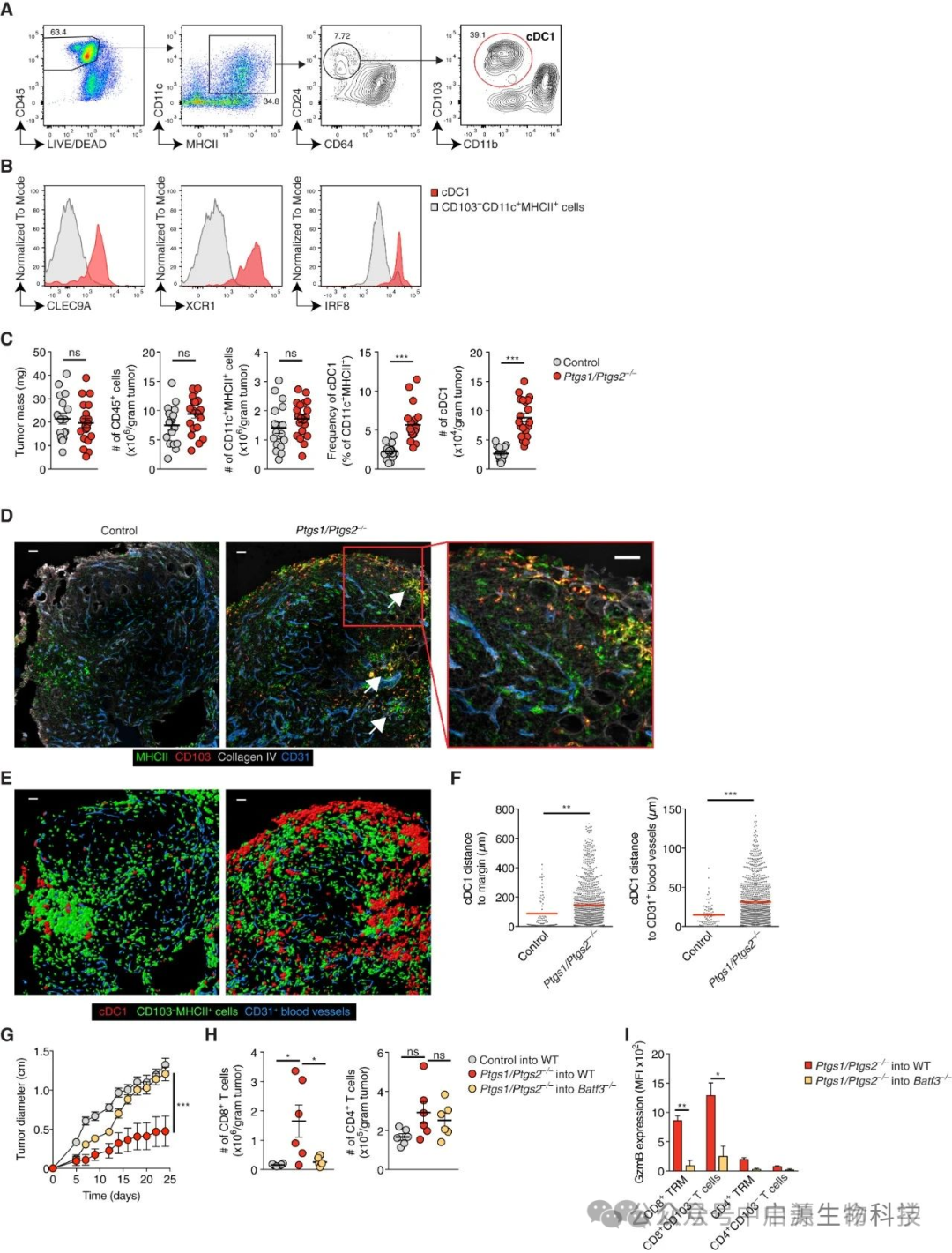
▲cDC1在PGE 2缺乏的肿瘤的TME中积累
而调控这一关键过程的核心机制,既非血流动力学因素,亦非癌细胞自主变异,而是——
自然杀伤(NK)细胞分泌的特异性趋化因子双信号系统:CCL5与XCL1。
具体机制如下:
-
CCL5 吸引CCR5+的cDC1进入肿瘤组织;
-
XCL1 则作用于XCR1受体,是cDC1特异性识别通道;
-
同时,GM-CSF促进cDC1成熟与抗原呈递能力;
有了这些“引路信号”,cDC1进入肿瘤后才能拾取抗原,迁移至淋巴结激活CD8+ T细胞,从而展开系统免疫应答。
即在完善的趋化因子引导下,cDC1完成以下关键免疫应答链:① 肿瘤抗原捕获 → ② 淋巴结定向迁移 → ③ CD8+ T细胞高效活化 → ④ 系统性抗肿瘤免疫应答建立
NK细胞在此过程中扮演着"免疫指挥官"的核心角色,通过分泌趋化因子构建生物分子通讯网络。
当NK细胞功能缺失时,将导致:
-
cDC1浸润受阻 → 形成"免疫荒漠化"肿瘤微环境
T细胞活化缺失 → 抗肿瘤免疫应答"信号中断"
即使存在强效免疫系统,也呈现"有力无处使"的困境
02
数据实锤:这一“免疫轴”影响生存期
研究团队通过多维度验证证实了这一发现:不仅在动物模型中观察到显著效果,通过对TCGA数据库中1,000余例人类肿瘤样本(涵盖乳腺癌、头颈癌、肺癌及黑色素瘤等)的大规模分析,研究人员获得了具有重要临床意义的发现:
1、肿瘤组织中NK细胞数量、CCL5/XCL1表达水平以及cDC1浸润程度越高的患者,其总体生存期显著延长;
2、这些免疫标志物的表达与CD8+ T细胞的浸润密度呈现明显的正相关性;
3、相反,那些发生免疫逃逸的肿瘤往往表现出NK细胞功能缺陷、趋化因子信号减弱以及cDC1细胞严重缺失的特征。
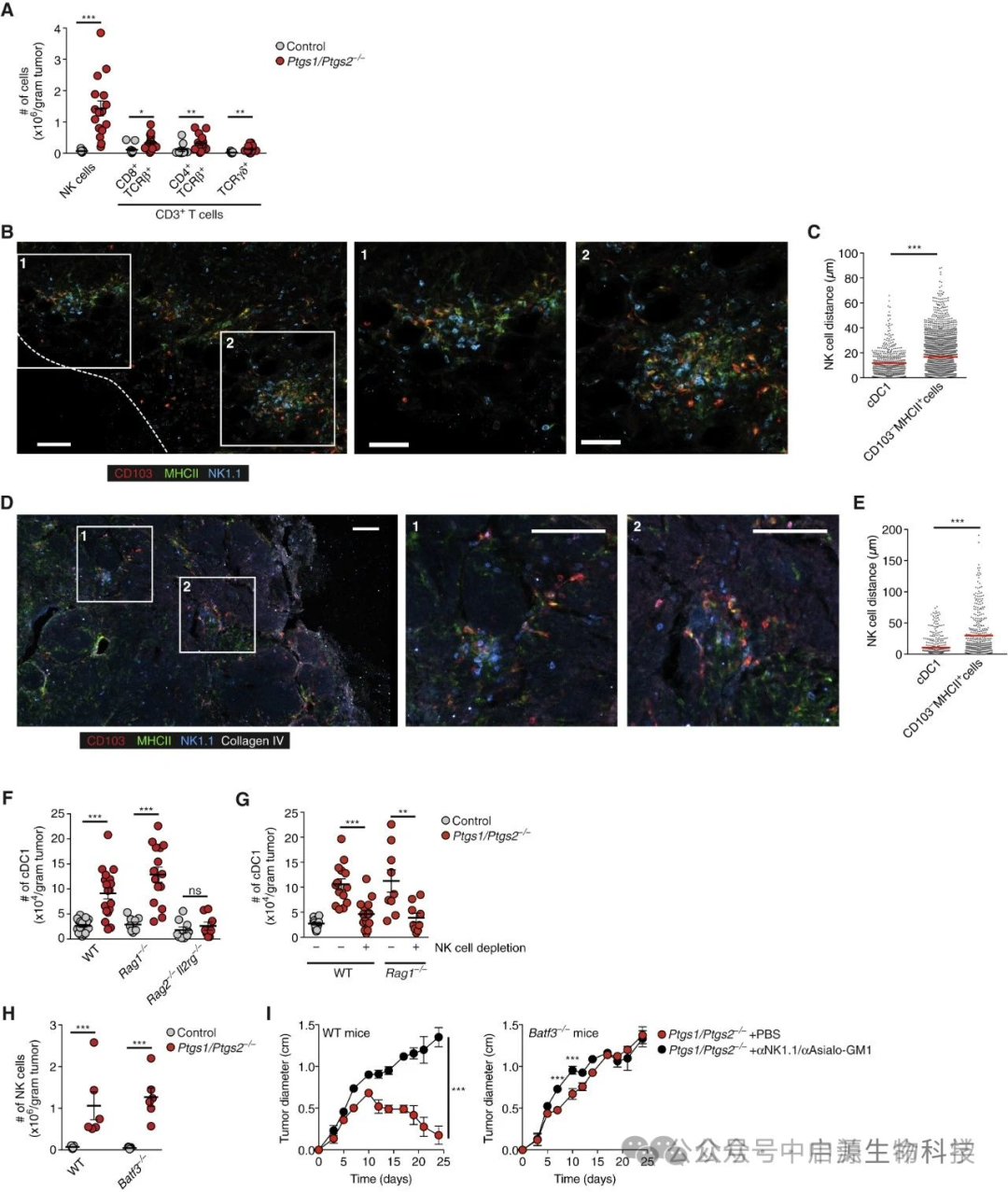
▲瘤内 cDC1 积累取决于 NK 细胞
换言之,患者对免疫治疗的反应不仅取决于PD-1、CTLA-4等免疫检查点的表达水平,更关键的是NK→cDC1→CD8这一免疫启动轴的功能完整性。
这一突破性发现不仅揭示了免疫治疗响应差异的内在机制,解释了为何部分患者对现有疗法无应答,更重要的是为临床实践提供了全新的生物标志物体系,将推动个体化免疫治疗方案的精准筛选。
03
肿瘤怎么“切断”这条路径?
PGE2是关键“破坏者”
然而一个关键问题随之浮现:既然NK-cDC1免疫轴在抗肿瘤应答中如此重要,为何在大多数实体瘤中这一通路会普遍失活?
深入研究表明,狡猾的肿瘤细胞演化出一套精密的免疫逃逸机制——通过分泌前列腺素E2(PGE2)这一强效免疫抑制因子,对NK细胞实施多维度"功能封锁":
-
抑制NK细胞内CCL5/XCL1合成;
-
干扰GM-CSF表达;
-
降低NK在肿瘤中的浸润活性;
-
进而阻断cDC1进入与激活T细胞的整个环节。
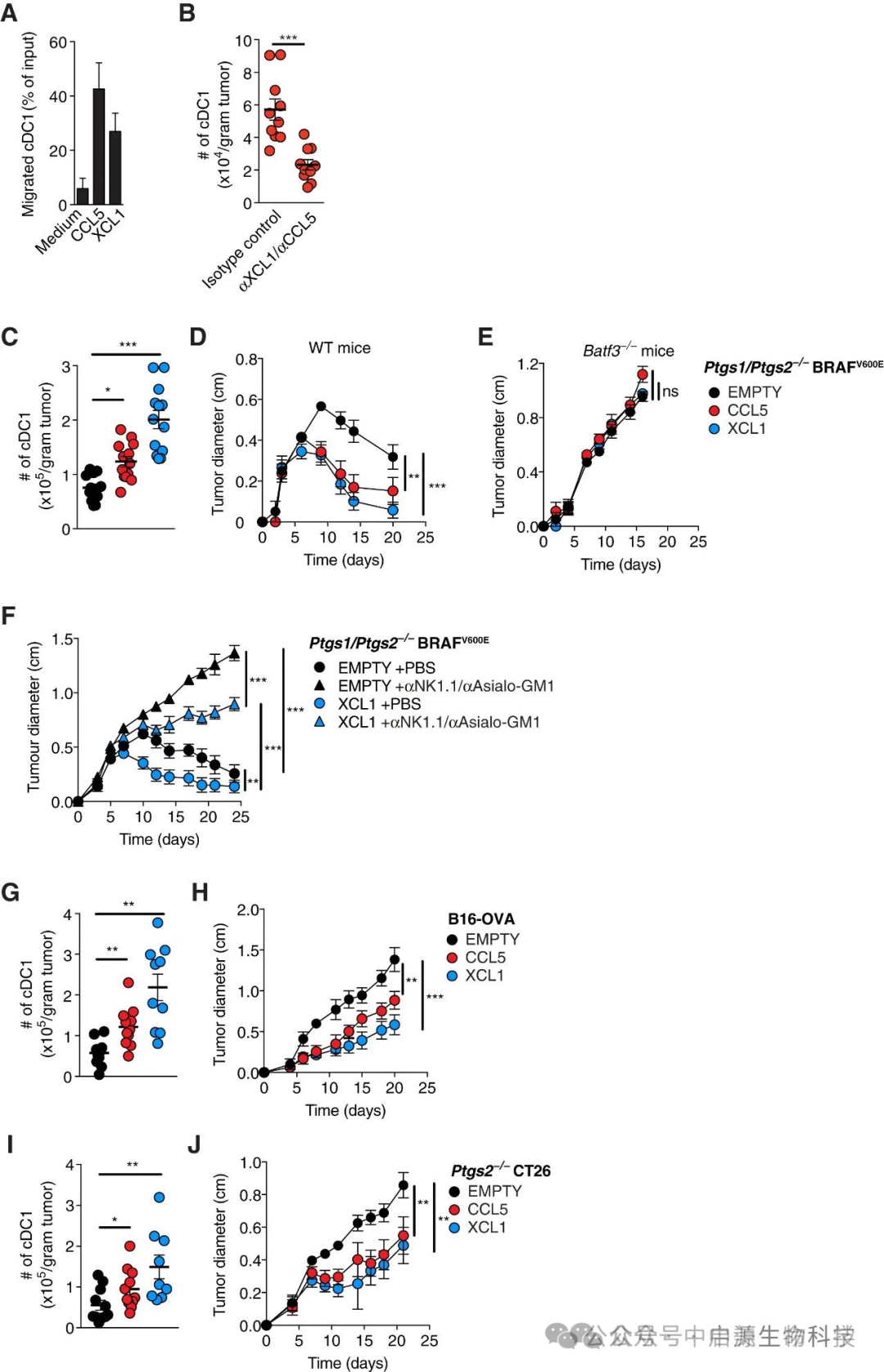
▲XCL1和CCL5募集cDC1进入肿瘤促进肿瘤免疫控制
这就像在战场上,敌军率先摧毁了我军的通讯基站和卫星导航系统——即便后续增援部队装备精良,却因失去战场定位而陷入"失联"状态。
但最新研究带来了突破性希望:通过药物联合阻断PGE2信号通路并激活NK细胞功能,能够成功重建"战场通讯系统"。这一发现为多种免疫耐受型肿瘤(如胰腺癌、三阴性乳腺癌)提供了可能的新策略。
04
产业启示:不能只做CD8和CAR-T
NK是免疫疗法的“流量入口”
这项里程碑式的研究彻底改写了我们对肿瘤免疫的认知:NK细胞绝非配角,而是整个抗肿瘤免疫反应的"总指挥官"和"第一响应者"。这一发现为肿瘤免疫治疗领域带来了范式转变,其产业影响深远而具体:
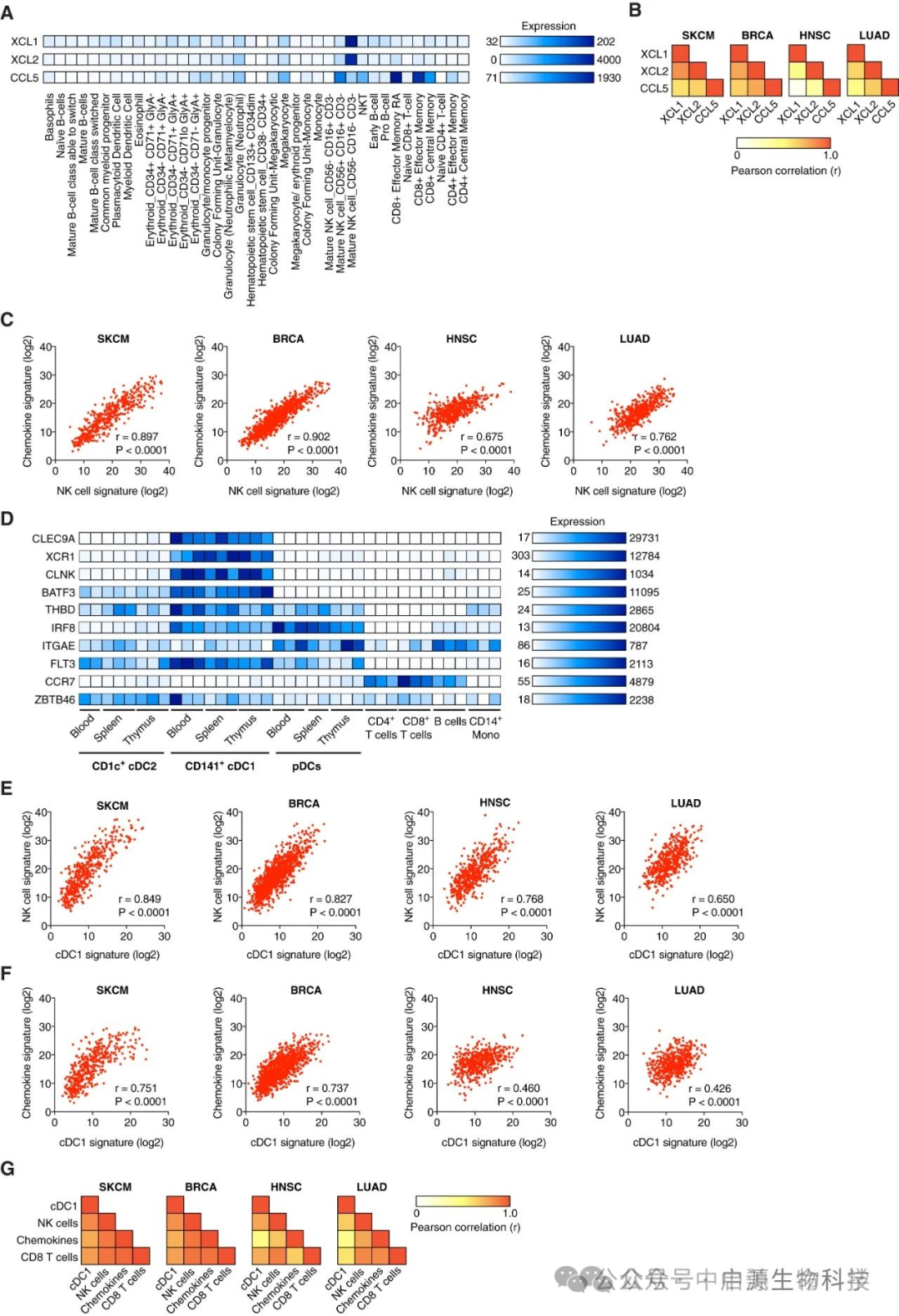
▲人类癌症中 NK 细胞、cDC1、CCL5、XCL1 和 XCL2 基因特征的互相关
1.免疫治疗新范式
单纯扩增CD8+T细胞犹如"无的放矢"
必须同步打通"抗原递呈-细胞招募"的绿色通道
否则CAR-T等疗法将永远困在"待机状态"
2.CAR-NK疗法的战略优势
直接杀伤肿瘤细胞
重建免疫微环境架构
尤其适合免疫"冷肿瘤"的破冰治疗
3.联合治疗新方向
突破现有PD-1/CTLA-4组合的局限
重点开发PGE2抑制剂+免疫激活剂的"信号重建方案"
4.诊断体系升级
现有免疫评分必须纳入NK功能指标
-
建立包含早期激活链条的"全程免疫评估模型"
这场免疫治疗的革命揭示了一个根本逻辑:在肿瘤战场上,"精准制导"比"狂轰滥炸"更重要。未来的治疗突破点,不在于培养更强的"杀手",而在于打造更聪明的"侦察兵"和更高效的"通信系统"。这标志着肿瘤免疫治疗正式进入"系统作战"的新纪元。
结语
我们曾以为NK细胞只是免疫系统中的"特种兵",以快速杀伤著称。但《Cell》研究揭示,它实则是整场免疫反应的"总指挥"——最早发现肿瘤、释放趋化因子信号、组织免疫大军协同作战。
而那些默默无闻、不引人注目的“趋化因子”,其实正是打通抗癌免疫闭环的密钥。
在未来肿瘤免疫策略中,我们不仅要激活T细胞,更要问一句:战场信号是否完整?前线部队是否听到了集结号?
NK细胞就是那个吹响第一声集结号的哨兵,用趋化因子搭建起免疫作战的指挥网络。它从不是孤独的杀手,而是被长期低估的战场指挥官,决定着整场抗癌之战的成败。

特别声明
本公众号所有文章旨在宣传生命科学领域的最新技术和研究,所有内容均不构成任何医疗指导。

本篇文章来源于微信公众号:中启源生物科技







