细胞科普丨Nature子刊:异体NK细胞可精准清除癌前细胞,提前将癌症拒之门外
点击蓝字 关注我们

引言
在大多数人的印象中,癌症像是一场突如其来的事故,今天一切正常,明天却突然被判“晚期”。但事实远比直觉更复杂。
癌变并非某一时刻突然发生的断裂,而是一个“被放过、被放任”的长期过程。人体免疫系统,原本负责清除异常细胞、识别恶性倾向,是这场战斗的第一道防线。然而,当这道防线悄无声息地垮塌时,癌症才有了发芽的机会。
2025年,《Nature Communications》刊登的一项研究首次实证:在骨髓增生异常综合征(MDS)的前驱阶段,即所谓“癌前状态”CCUS(Clonal Cytopenia of Undetermined Significance)中,正是自然杀伤细胞(NK细胞)率先发生功能性失调,为异常克隆细胞的存活与扩张开了绿灯。
更重要的是,研究团队还发现,源自健康供体的异体NK细胞能够精准识别并清除这些前癌细胞,而不会误伤正常造血细胞。这意味着,癌前免疫干预的现实可能正在到来,且路径清晰、手段成熟,关键就在于“谁来出手”。
01
从克隆异常到血癌
免疫系统的沉默是一切的起点
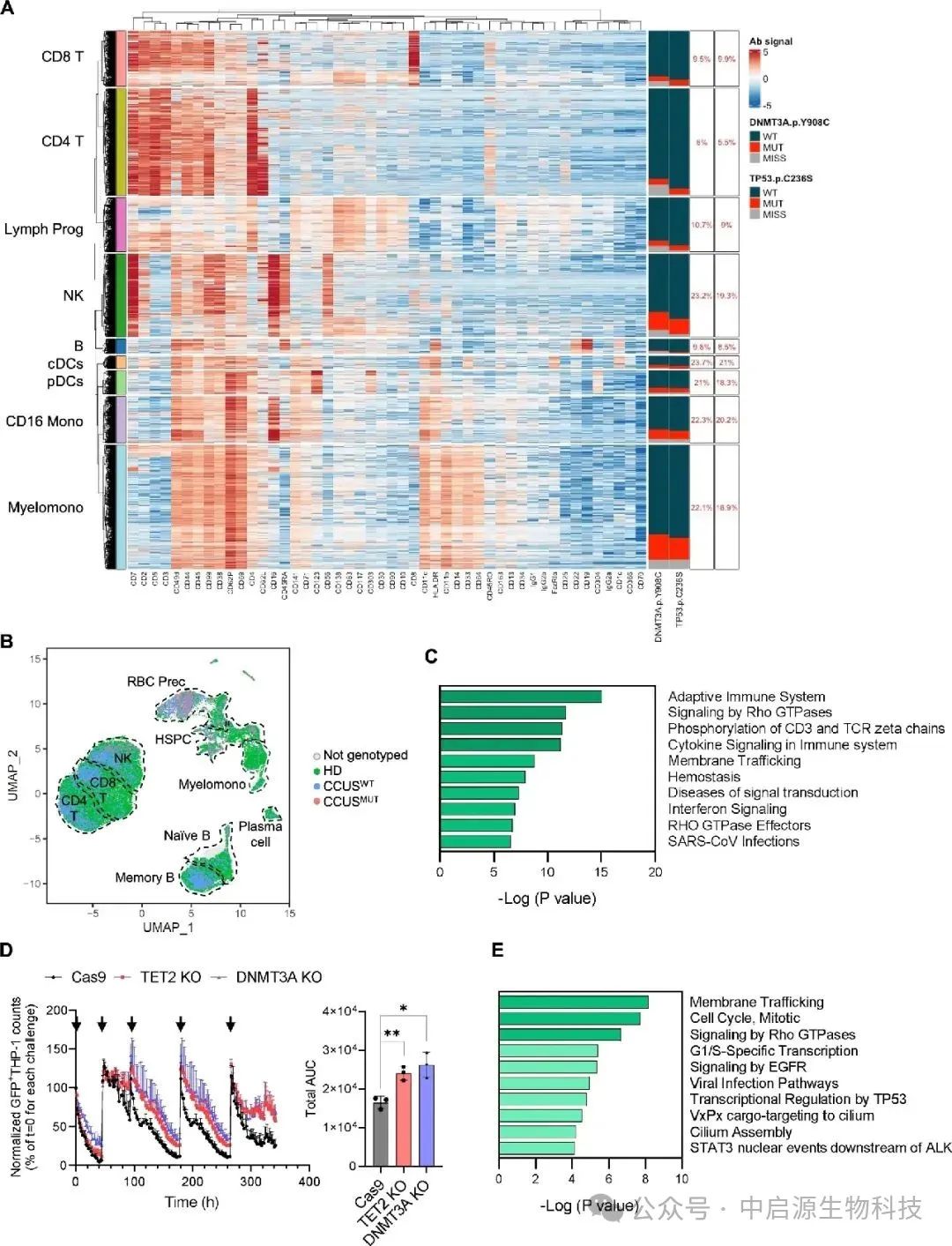
CCUS常被误认为是一种“观察期”的病理状态,患者造血功能轻度异常,骨髓中出现一些突变的细胞克隆,但尚未达到MDS的诊断标准。
临床上,多数医生仍将其视为“未必发展”的灰区,不建议治疗。但研究显示,超过80%的CCUS患者在5年内将发展为MDS,极少数甚至可直接进展为急性白血病。这不是偶然,而是一个潜移默化、由免疫失控驱动的渐变链条。
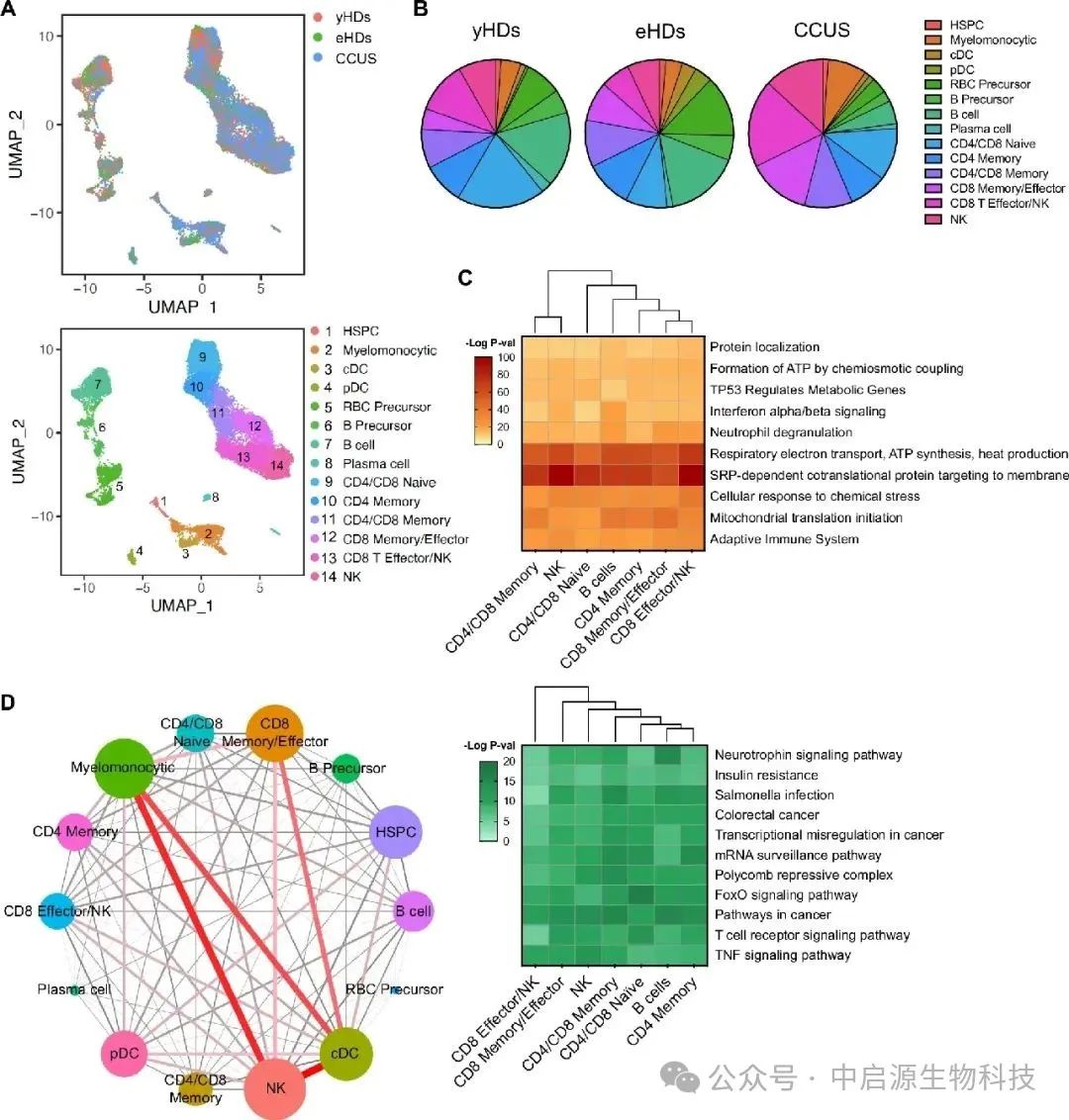
本研究通过对早期MDS和CCUS患者的骨髓样本进行单细胞组学分析,发现一个值得警觉的趋势:这些患者体内的NK细胞虽然数量尚可,表面活化指标也存在,但其功能性却严重衰减。
它们不再释放有效的细胞毒素,无法有效识别带有突变标记的异常细胞。更值得注意的是,部分功能失常的NK细胞自身也携带造血干细胞层级的突变,说明这一免疫亚群已经“被污染”,无法维持应有的免疫监视作用。
这意味着,癌症从不是某一细胞孤立作乱的结果,而是一场系统性放权。当NK细胞停止执行清除命令,前癌克隆便得以逐步扩张,最终形成不可逆的病理改变。免疫防线的瓦解,不是因为外力强大,而是因为内部失控。
02
异体NK细胞的精准清除能力
为癌前干预打开新路径
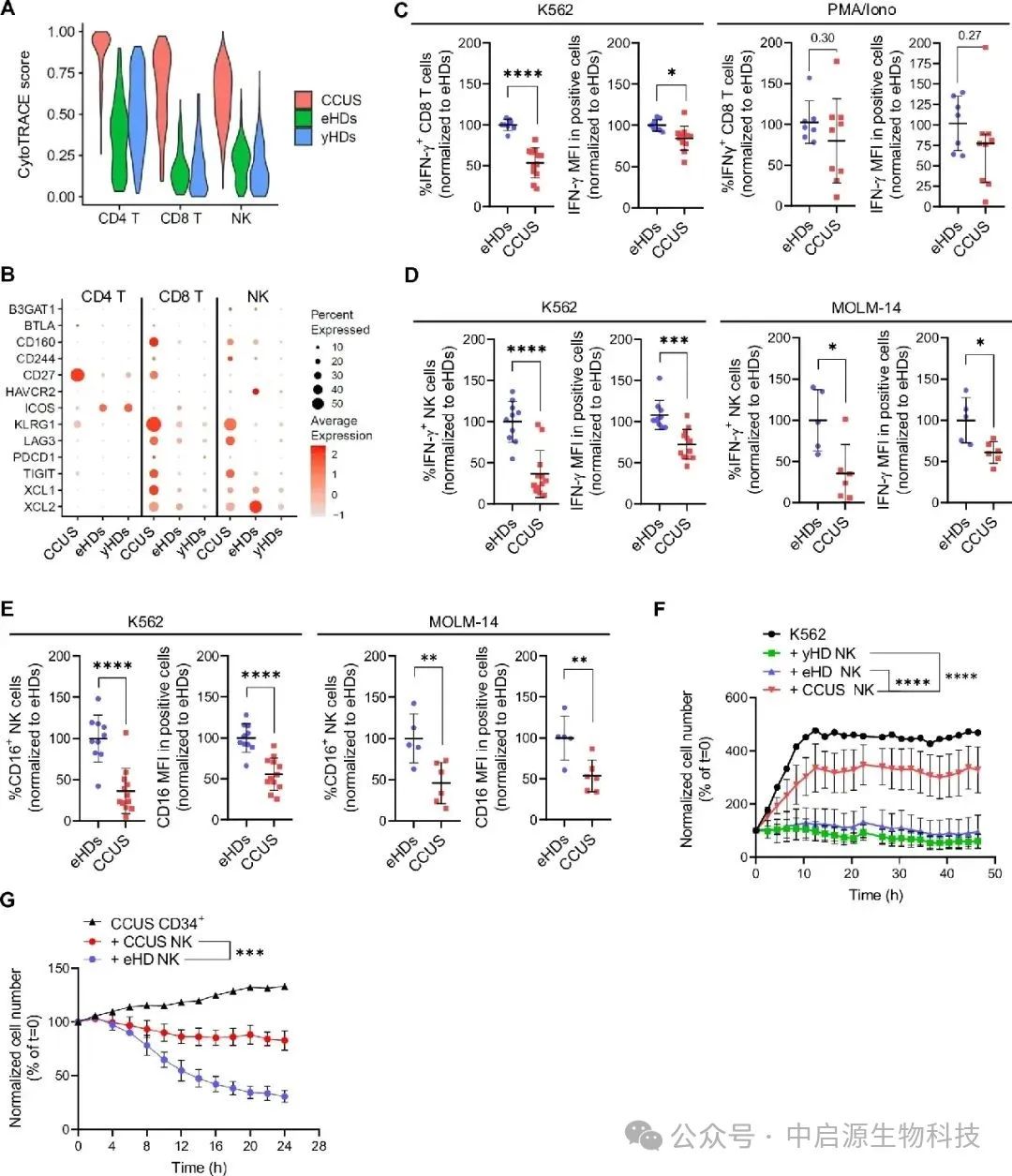
面对患者自体NK细胞的功能衰竭,研究团队进一步设计了验证实验。他们将带有前癌突变克隆的人类造血干细胞移植至人源化免疫缺陷小鼠体内,分别注射来自患者自身与健康供体的NK细胞。
实验结果展现了显著反差:患者自体NK细胞几乎毫无清除能力,而健康供体的异体NK细胞能够精准地将带突变标记的克隆细胞识别并杀伤,同时保留正常造血系统的完整性。
▲CCUS 患者的免疫细胞被激活
这不仅仅是一次机制层面的突破,更是临床策略上的颠覆。过去,免疫治疗几乎默认“癌症已经发生”,重点放在中晚期控制、延长生存或减缓复发。
而本研究首次将治疗窗口前移至癌变发生之前,证明异体免疫干预不仅理论可行,且具备“高识别率+低毒副反应”的双重优势,提供了一种不依赖化疗、不需造血干细胞移植的早期清除方案。
对那些被标注为“观察随访”的CCUS患者而言,这意味着或许不再需要等待病情进展才启动治疗,而是有机会通过“免疫接管”,提前阻断恶变通路。这一发现为NK细胞疗法在早筛人群中的应用奠定了理论基础。
03
免疫治疗从“抗癌”走向“防癌”
临床边界正在改写
当前,免疫细胞治疗仍以治疗中晚期肿瘤为主要适应症,NK细胞亦多用于实体瘤、白血病复发后的靶向辅助。
然而,从“癌后控制”转向“癌前防线”,已成为全球免疫医学研究的重要趋势。以往由于缺乏明确机制、缺乏前瞻性指标、缺乏高选择性的免疫武器,癌前干预在临床上始终是“理想大于现实”。
▲CCUS 患者的NK细胞功能失调
而此次Nature子刊发表的实证研究正是填补这三大缺口的关键一环:
首先,机制上明确了NK细胞功能失调是癌前状态的决定性转折点,甚至优于传统的基因突变数量预测;
其次,模型验证提供了可控可视的靶向窗口,实验动物中的清除效果非常接近真实人体情况;
第三,更重要的是,异体NK细胞来源于健康供体,无需配型匹配,也不引发移植物抗宿主病(GVHD),具有即时应用的现实优势。
临床上,一旦与现有的高通量筛查技术(如cfDNA突变检测、骨髓微环境评估)结合,将为高危人群定制“免疫阻断干预计划”成为可能。未来,我们或许可以不再等待癌症成形,而是像预防乙肝那样,在疾病启动前完成免疫“封杀”。
04
从精准筛查到个体化免疫介入
NK疗法可成为“无创癌前疫苗”
事实上,癌症从发生到发现,有时要经历3至7年的“潜伏期”。在这个阶段里,患者症状轻微,影像学和常规指标都不足以发出警报,而异常克隆却已在骨髓或其他组织中悄然扎根。依靠常规体检进行发现几乎不可能,传统的“等它成形再治疗”模式严重滞后。
▲MDS驱动基因的体细胞突变诱导CCUS NK细胞功能障碍
正因如此,基于免疫机制的个体化干预正在成为精准医学的下一个高地。NK细胞天生具备对非典型异常信号的“先天识别”能力,天然不依赖抗原呈递,也不需要T细胞激活,这使它们在面对非典型肿瘤前体时依然具备识别与杀伤优势。
而通过异体NK细胞的制备、冷冻、标准化运输,建立“癌前免疫疫苗库”成为现实可能。
更进一步,未来甚至可以在特定人群中实现——筛查-识别-干预的三步走闭环:
1、检测发现携带高危突变、克隆性异常,但尚未进入癌变;
2、注射个性化扩增的异体NK细胞进行“先清除”;
3、后续通过干细胞营养支持或菌群重建,重启自身免疫修复功能。
这种模式一旦成熟,不仅可适用于MDS、CCUS,也有望拓展至乳腺不典型增生、胃肠道异型增生、口腔黏膜白斑等“癌前可逆区”。NK细胞不再只是“晚期的陪练”,而将成为“癌前阻击”的正面战士。
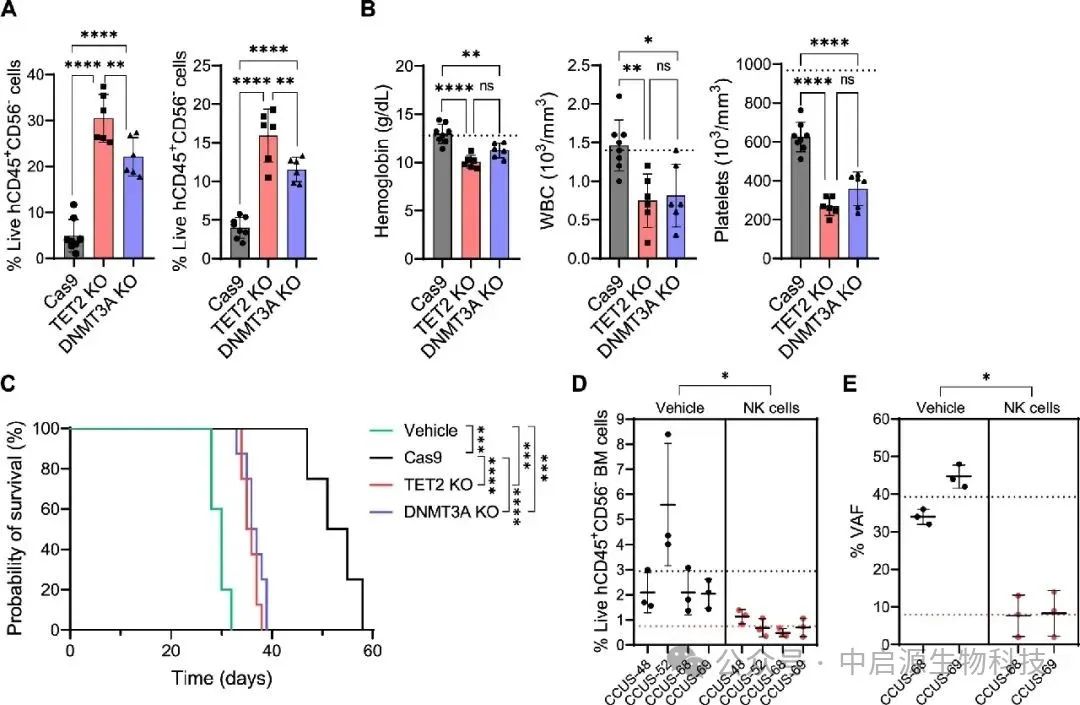
▲来自HD的NK细胞有效地靶向CCUS突变细胞
05
重建防线,比亡羊补牢更重要一百倍
肿瘤治疗的最理想状态,从来都不是“拖住它”,而是“让它永远别来”。这听上去像是预防医学的范畴,但这项研究告诉我们,它完全可以是“免疫治疗”的主战场。不是一味延长患者存活,而是彻底阻断病变路径,在起点处设立清除机制。
异体NK细胞的崛起,正是这种思维变革的产物。它代表着医学从病理打击向生理预警的跨越,从以病灶为中心转向以免疫能力为核心。
未来,医生可能不再说“你的指标还在正常范围,先观察”,而是说“你的免疫识别功能正在减退,可以考虑早期NK干预”;体检报告也不仅是红字提醒,而是免疫评分+干预推荐,癌症成为可以预防、可监控的代谢过程,而非命运突袭。
当人类开始主动重建自己身体里的防御体系,很多我们以为不可阻挡的疾病,其实都可以被提前拒之门外。


本公众号所有文章旨在宣传生命科学领域的最新技术和研究,所有内容均不构成任何医疗指导。

本篇文章来源于微信公众号:中启源生物科技







