细胞科普丨Nature实锤:免疫系统老化会拖垮全身器官!NK细胞或成逆转衰老“主力部队”
点击蓝字 关注我们
ENTERPRISE

引言
衰老并非一场毫无征兆的全面崩溃,而是一个缓慢且系统性的失控过程。在这个过程中,最早出现问题的系统往往被人们忽视。
2021年,《Nature》杂志发表了一项开创性的研究,首次明确指出:免疫系统的衰老并非全身器官衰老的结果,而是其起因。当免疫细胞的“指挥能力”减弱时,它们不仅无法有效抵御疾病,还会主动释放“衰老信号”,促使肝脏、肾脏、骨骼、肌肉、神经系统等器官相继加速退化。

这表明,与其被动地逐一修复各个器官,不如回归源头,激活掌控全身健康的“免疫中枢”。
在众多免疫细胞中,NK细胞正被认为是最具抗衰潜力的“种子选手”。一场从免疫细胞出发的抗衰革命,已在《Nature》的见证下正式拉开帷幕。
01
Nature证据:免疫系统“拖老”身体

Yousefzadeh等科学家在《Nature》上发表的研究成果,首次借助遗传学技术精准模拟了“免疫系统单独衰老”的独特状态,并揭示了免疫系统衰老足以反向推动全身实质性器官进入“早衰”进程。
研究团队精心构建了一种特异性衰老小鼠模型。通过Vav-iCre系统敲除造血干细胞中的Ercc1基因,使小鼠的免疫系统因DNA修复缺陷而提前老化,而身体其他系统则保持年轻状态。这一巧妙的模型成功地剥离了“免疫衰老”与“全身衰老”之间的因果关系。
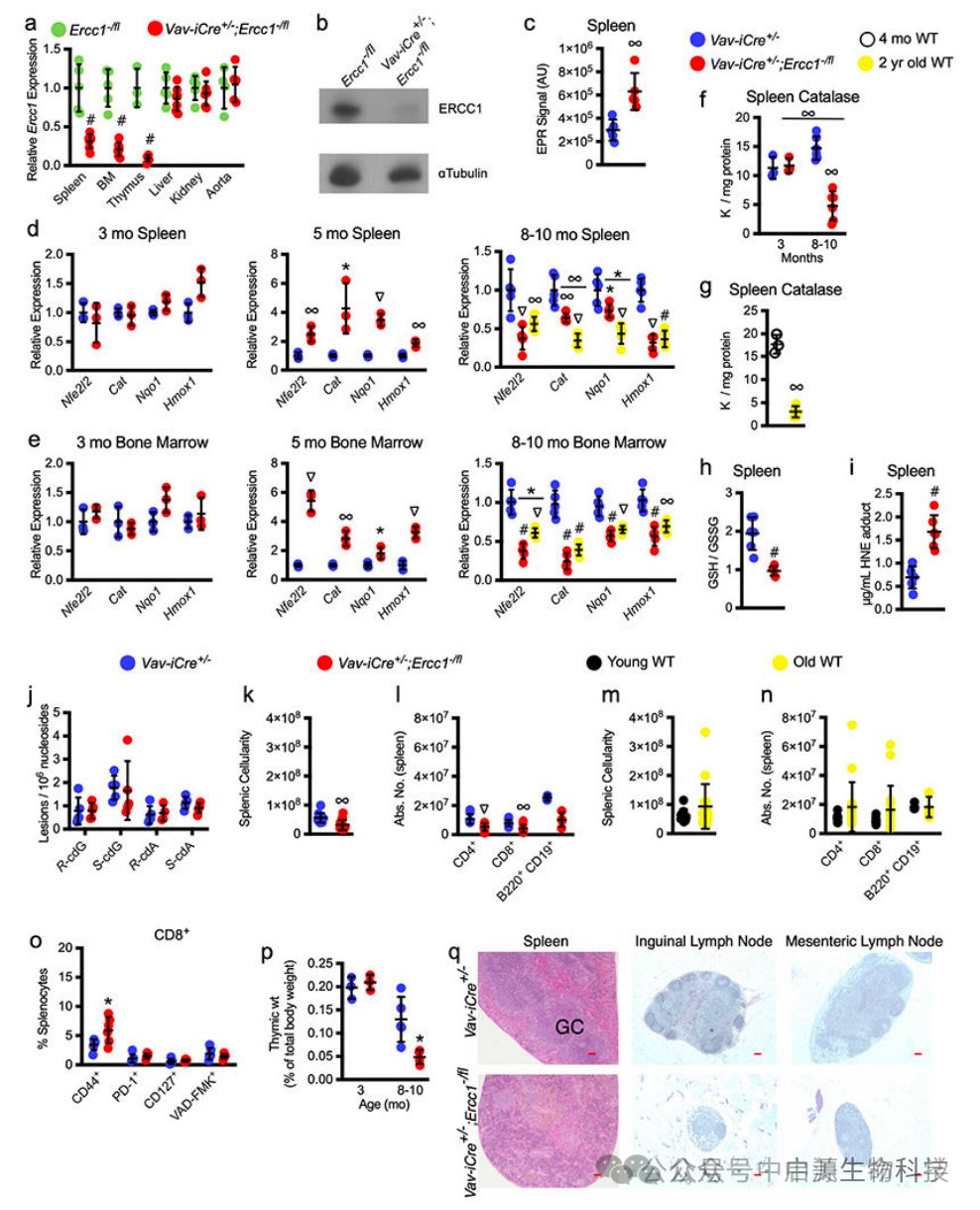
▲ 扩展数据 图 1 |.Vav-iCre 的分子变化;Ercc1 小鼠
结果显示,仅免疫系统的衰老,就足以导致小鼠的肝脏、肾脏、脊柱间盘、骨骼、肌肉等多个组织出现显著的DNA损伤积累、炎症因子上调以及细胞更新速度减缓等衰老的典型标志。
这些变化并非源于器官自身的原发性衰老,而是由免疫细胞释放的促炎因子(如IL-6、TNF-α、IFN-γ)和SASP信号诱发的“旁观者衰老”效应,从而导致全系统加速退化。
更令人惊叹的是,研究人员将年轻小鼠的免疫系统移植到这些免疫衰老模型中,竟然成功地延缓了全身器官的老化进程,降低了p16、p21的表达水平,并修复了DNA损伤。这一切明确指向一个事实:免疫系统并非衰老的“受害者”,而是最早且最有可能主导衰老进程的“源头变量”。
这项研究彻底颠覆了过去“器官先衰老,免疫随之疲软”的传统认知,提出了一个更具突破性的科学命题——抗衰的关键,必须从免疫系统入手。
02
免疫细胞如何“指挥”器官衰老

我们通常认为,免疫系统的主要任务是“守门”——抵御病毒入侵、清除病变细胞、维持身体内稳态。然而,越来越多的研究表明,免疫系统的角色远不止于此。免疫细胞不仅是防御的卫士,更是全身性生物时钟的重要调节者。一旦免疫细胞老化,它们可能会成为最先“破坏秩序”的关键因素。
具体来说,随着年龄的增长,T细胞、NK细胞、巨噬细胞等核心免疫细胞的功能会发生多方面的变化:细胞毒性减弱、激活阈值升高、趋化能力下降。更严重的是,这些免疫细胞会进入一种“炎症性衰老”状态,开始大量分泌衰老相关分泌表型(SASP)因子,如IL-6、IL-1β、TNF-α等。这些因子具有强烈的促炎作用,会引发周围非免疫细胞的应激反应,进而导致这些细胞也进入“伴随性衰老”状态。
▲ 扩展数据 图 2 |.Vav-iCre;Ercc1mice 保持正常的体重和身体成分
这一机制正是“非细胞自主性衰老”的核心所在:器官本身并未遭受直接的致命打击,却因免疫系统释放的慢性炎症信号,被迫提前踏上退化的轨道。这也在很大程度上解释了为何许多中老年人常常出现“系统性无症状炎症”,以及器官功能逐年下降却难以找到明确病因的现象。
更关键的是,免疫系统的老化具有传播性。正如研究所示,将老年小鼠的造血干细胞移植到年轻小鼠体内,也会使其器官的衰老标志物显著增加。这意味着,免疫细胞的老化不仅会“自损”,更会“传损”至其他部位。
换句话说,在衰老这场系统性失控的进程中,免疫细胞不仅仅是被动的执行者,它们很可能是这场混乱的元凶。这正是我们必须从免疫层面入手,制定抗衰战略的根本逻辑所在。
03
NK细胞衰老机制与重建可能

在免疫系统的庞大军团中,NK细胞(自然杀伤细胞)堪称“特种部队”——它们无需依赖抗原呈递,也不需要前期识别,就能直接清除肿瘤细胞、病毒感染细胞,甚至是衰老细胞,拥有与生俱来的免疫监视功能。
然而,随着年龄的增长,NK细胞自身也悄然步入衰老的轨道,其功能的下滑成为了系统性免疫衰退的前哨。
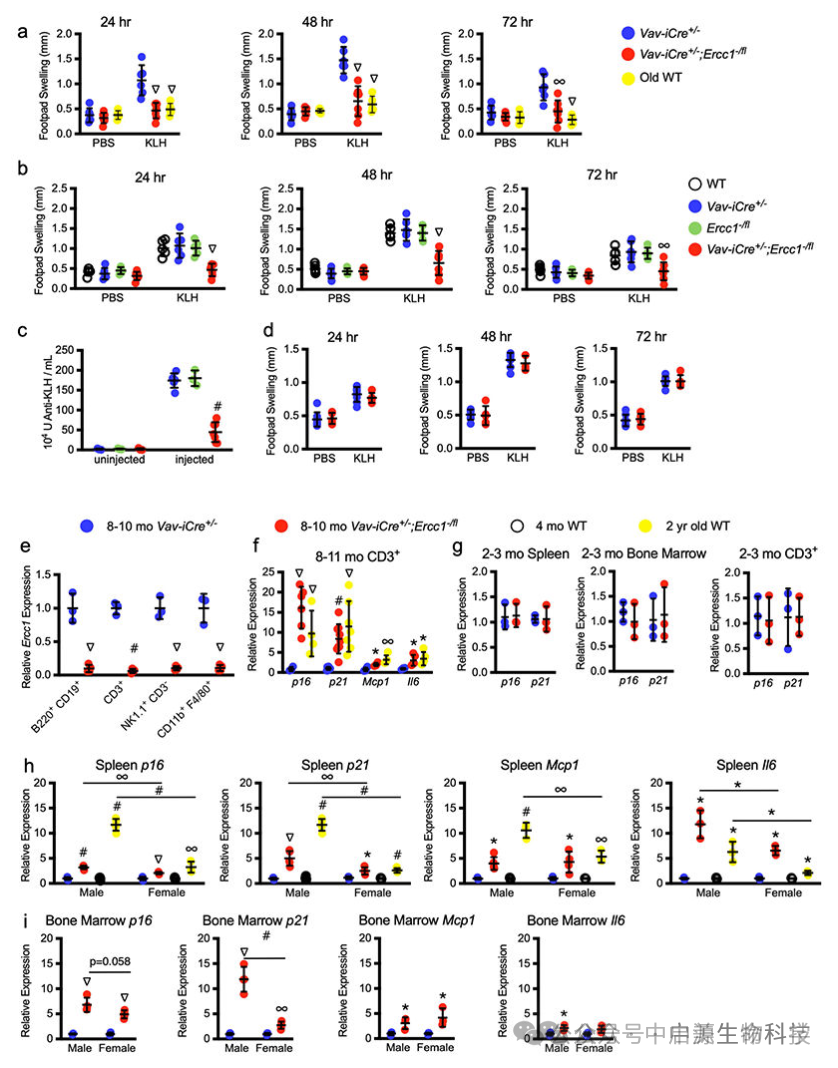
▲ 扩展数据 图 3 |.Vav-iCre 中免疫功能和淋巴器官衰老的测量;Ercc1 小鼠。
研究发现,40岁之后,人体NK细胞的数量与活性开始显著下降,到了60岁,其杀伤活性可能仅为青年时期的50%。这种衰退并非简单的“退休式”钝化,而是伴随着细胞表型的变化:关键杀伤通路标志物(如CD16、NKG2D、Perforin)的表达逐渐下调,趋化能力减弱,细胞毒性释放效率降低。与此同时,NK细胞自身也可能积累DNA损伤、线粒体耗竭,逐渐转向“免疫疲惫”状态。
但令人欣慰的是,NK细胞是目前已知最具“重塑性”的免疫细胞之一。一项发表于《Frontiers in Immunology》的研究指出,体外扩增的NK细胞在回输后能够迅速迁移到淋巴和肝脏组织,表现出高表达的活性标志,甚至具备针对特定靶点(如肿瘤或衰老细胞)的“增强适应性”。
此外,已有研究(如发表于《Stem Cells Translational Medicine》)通过细胞因子组合(如IL-2、IL-15)或低温冻存再激活技术,成功实现了“老化NK细胞的回春”:包括杀伤力的恢复、趋化因子分泌的重启,甚至是对自身免疫微环境的二次调控功能。
这一切为我们打开了一扇充满希望的大门——通过强化或回输年轻的NK细胞,或许可以逆转免疫系统的衰老生态,进而延缓系统性器官的退化进程。
04
NK细胞疗法如何逆转“免疫拖累”

如果说免疫衰老是器官衰老的信号源头,那么重建免疫功能,就是“断流式抗衰”的上游手术刀。而在众多免疫干预方式中,NK细胞疗法正逐步成为抗衰老最具转化潜力的路径之一。
目前主流NK细胞疗法多采用两类策略:一是自体NK细胞扩增激活回输,即从患者自身血液中提取NK细胞,体外扩增10~14天,通过IL-2/IL-15刺激恢复其杀伤活性和细胞代谢后回输;二是异体供体NK细胞直接移植,通常来源于脐带血或健康供者,经筛选与激活后作为“外援”输入。这两类策略都已在恶性肿瘤治疗中广泛开展,并逐步拓展至免疫衰老与抗炎场景。
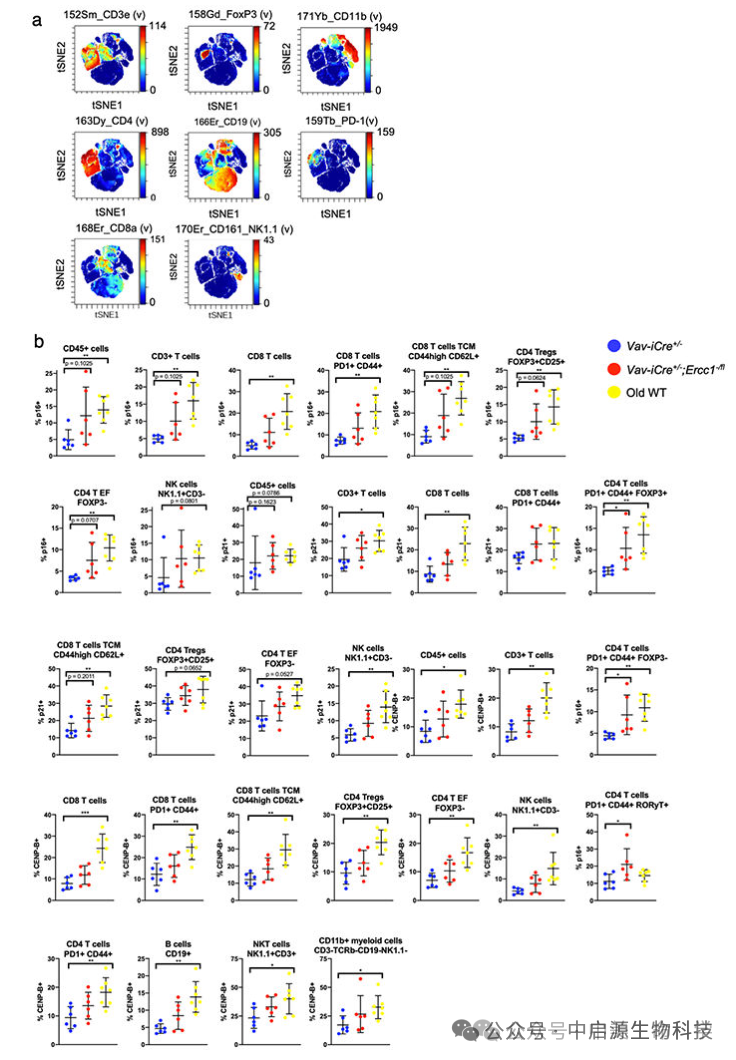
▲ 扩展数据图 4 |.通过 CyTOF 鉴定免疫细胞类型和衰老细胞。
美国Mayo Clinic与东京大学医学院联合在《Stem Cells Translational Medicine》上发表的一项开创性研究,首次将回输NK细胞应用于健康的中老年志愿者,探索其对“低度炎症状态”和衰老标志物的影响。
研究结果显示:经过连续3次NK细胞输注后,受试者外周血中与炎症相关的基因表达显著下降,包括p16Ink4a、IL-6和TNF-α等,同时CD56bright型NK细胞的比例显著回升。此外,受试者还表现出疲劳感减轻、睡眠质量改善以及肌肉强度回升等临床指标的积极变化。
另一项2022年发表于《Aging Cell》的动物实验也证实,NK细胞能够靶向清除脂肪、肝脏和肌肉中积累的衰老细胞,并激活旁系干细胞修复通路,从而提升组织的再生能力,延缓代谢性老化。
这些研究共同表明:激活或补充高质量NK细胞的意义远不止于“增强免疫”,更是从源头上“恢复系统秩序”的关键工程。在未来的抗衰领域中,NK细胞疗法很可能成为连接“免疫修复”与“器官抗老”的重要桥梁。
特别声明

本公众号所有文章旨在宣传生命科学领域的最新技术和研究,所有内容均不构成任何医疗指导。

本篇文章来源于微信公众号:中启源生物科技







